
Činjenica da atom ugljika u jezgri može imati 6, 7 ili 8 neutrona, čini se, ne zanima nikoga osim kemičare i fizičare. Ipak, spoznaja da atomi istoga kemijskog elementa mogu imati različite mase izuzetno je utjecala na razvoj znanosti i tehnologije u 20. stoljeću.
Prirodni kemijski elementi većinom postoje kao smjese dvaju ili više izotopa. Izotopi istog kemijskog elementa imaju jednak broj protona, ali se razlikuju brojem neutrona. Primjerice, svi atomi ugljika imaju šest protona u atomskim jezgrama.
Međutim, kemijski element ugljik čine tri izotopa ugljika, tj. atomi ugljika sa šest, sedam ili osam neutrona u atomskim jezgrama. Zbog toga izotopi ugljika imaju različite mase, ali imaju jednaka kemijska svojstva jer ona ne ovise o masi atoma.
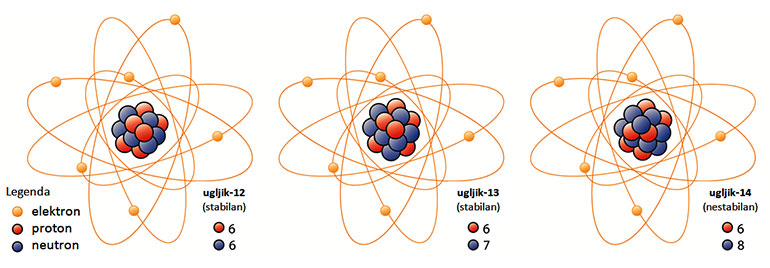
Postoje stabilni i nestabilni izotopi. Nestabilni ili radioaktivni izotopi spontano se raspadaju. Opisanu pojavu nazivamo radioaktivnošću, reakciju pretvorbe jednog elementa u drugi uz emisiju zraka radioaktivnom pretvorbom, a takav kemijski element radioaktivnim. Prirodna je radiokativnost spontano zračenje atomske jezgre, pri čemu nastaje nova vrsta atoma.
Pojavu radioaktivnosti uočio je francuski fizičar Henri Becquerel 1896. godine, koji je ustanovio da uranijeve rude i spojevi spontano, bez ikakva vanjskoga djelovanja, emitiraju prodorne zrake. Na njegova ispitivanja nadovezala se poljska znanstvenica Marie Skłodowska Curie, koja je sa suprugom Pierreom Curiejem uspjela izolirati iz uranijeva smolinca radioaktivni polonij. Supružnici Curie iste su godine izolirali još aktivniji radij, a samu pojavu zračenja nazvali radioaktivnošću. Godine 1903. za otkriće radioaktivnosti H. Becquerelu i supruzima Curie dodijeljena je Nobelova nagrada za fiziku.
Radioaktivni izotopi omogućili su točno određivanje starosti stijena Zemlje i Mjeseca, arheoloških iskopina, pa čak i podzemnih voda i vina. Danas se prema izotopnom sastavu kisika u mjehurićima zraka zarobljenog u grenlandskom ledu može odrediti temperatura na Zemlji prije mnogo milijuna godina.
Izotopi uranija i ugljika kao mjerači vremena
Brzina raspada radioaktivnog izotopa iskazuje se s pomoću vremena poluraspada, koje je jednako vremenu potrebnom da se takav izotop raspadne na polovicu prvobitnoga broja atoma.
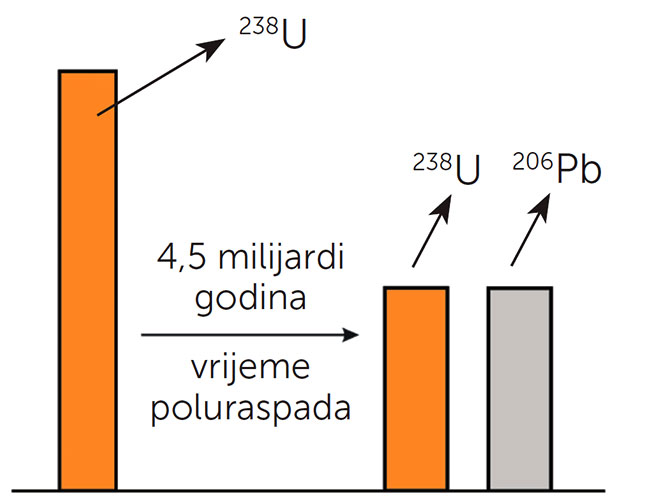
Brzina je radioaktivne pretvorbe stalna, pa su zato prirodni raspadni nizovi poznatoga vremena poluraspada svojevrsni mjerači vremena, s pomoću kojih možemo izračunati starost Zemlje i stijena koje ju izgrađuju. Tako se radioaktivni uranij-238 na kraju radioaktivnog raspada pretvara u neradioaktivno olovo.
Budući da znamo kako je vrijeme poluraspada uranija-238 oko 4,5 milijarda godina, možemo iz omjera masa uranija i olova u stijeni odrediti njezinu starost.
Prirodni ugljik sastoji se od triju izotopa, ugljika-12, ugljika-13 i ugljika-14. Nestabilni izotop ugljik-14 nastaje zbog djelovanja zračenja iz svemira na atome dušika u visokim slojevima atmosfere. Reakcijom nastalih atoma ugljika s kisikom nastaje ugljikov dioksid, koji se fotosintezom u biljkama pretvara u škrob te hranidbenim lancem ulazi u svako živo biće na Zemlji. Udio izotopa ugljika-14 u atmosferi je stalan kao i u svim živim organizmima. Nakon prestanka života u ostatcima organizama udio izotopa ugljika-14 smanjuje se (svakih 5730 godina polovica se atoma ugljika-14 raspadne) te se tako može odrediti točna starost ostataka do unatrag 50.000 godina.
Tu je metodu određivanja starosti ugljikovim izotopima razvio Willard Libby potkraj 40-ih godina 20. stoljeća te je za svoja istraživanja dobio i Nobelovu nagradu 1960. godine. Metoda je postala sastavnim dijelom arheoloških istraživanja.
Važno je napomenuti da se metodom datiranja ugljikom-14 određuje starost materijala, a ne predmeta koji je od tog materijala izrađen. Primjerice, ako se određuje starost drvenog kipa, tom ćemo metodom odrediti vrijeme kad je drvo prestalo rasti, a ne kad je neki umjetnik izradio kip.

U Hrvatskoj se određivanje starosti s pomoću izotopa ugljika provodi u laboratoriju Instituta Ruđer Bošković u Zagrebu. U njemu je analizirano mnogo uzoraka, a za hrvatsku su arheologiju bila važna datiranja paleolitske kulture u špiljama Bezdanjača, Šandalja, Velika pećina i Vindija, antičkog brodovlja (Punta sv. Ivana, Zlarin), antičke luke (Gradina, Vranjičko blato), staroga hrvatskog brodovlja (Nin), crkve sv. Donata i škrinje sv. Šimuna u Zadru, naselja iz željeznog doba (Kaptol u Požeškoj kotlini) i rimskog doba (Šćitarjevo, Sisak, Varaždinske Toplice), eneolitska naselja u Vinkovcima i Vučedolu (badenska, kostolačka i vučedolska kultura) itd.
Naslovna slika prikazuje uređaj za određivanje starosti uzoraka izotopima ugljika u Nacionalnom laboratoriju Lawrence Liveromre (SAD). Izvor slike je mrežna stranica http://www.symmetrymagazine.org/
Literatura: Lukić, S., Varga, M., Dujmović, I., Trenčevska, N., Volarević, D.: Kemija 7, udžbenik kemije u sedmom razredu osnovne škole, Školska knjiga, Zagreb, 2013. ■ Tkalčec, B., Petreski, A.: Kemijski elementi i njihovi spojevi, udžbenik kemije u trećem razredu gimnazije, Školska knjiga, Zagreb, 2013. ■ Krajcar Bronić, I., Horvatinčić, N., Obelić, B.: Određivanje starosti metodom ugljik-14, Laboratorij za mjerenje niskih aktivnosti, Institut Ruđer Bošković, Zagreb, 1999.
Piše: Goran BUKAN

